Gruppe 4
PH bei pulmonalarterieller Obstruktion
Definition
Die pulmonale Hypertonie (PH) assoziiert mit pulmonalarteriellen Obstruktionen bildet die PH-Gruppe 4 gemäß WHO- und Nizza-Klassifikation.1
Bei Anzeichen von postthromboembolischen fibrotischen Obstruktionen in der Lungenarterie sollte die Diagnose einer chronisch thromboembolischen Lungenerkrankung ohne PH (CTEPD) bzw. mit PH (CTEPH, PH-Gruppe 4) erwogen werden.1
Hämodynamische Definition der PH-Gruppe 4 (präkapilläre PH):1 | |
|---|---|
Mittlerer Pulmonalarteriendruck (mPAP) | > 20 mmHg |
Pulmonalarterienverschlussdruck (PAWP) | ≤ 15 mmHg |
Pulmonalvaskulärer Widerstand (PVR) | > 2 WU |
Klassifikation
Die CTEPH kann sich infolge von pulmonalarteriellen Obstruktionen oder einer damit assoziierten Mikrovaskulopathie entwickeln.1
Die WHO-Klassifikation gliedert die Gruppe nach ihrer Ätiologie in folgende Unterformen:1,2
Chronische thromboembolische PH (CTEPH)
Andere pulmonalarterielle Obstruktionen
Zu den alternativen Ursachen von pulmonalarteriellen Obstruktionen gehören Sarkome, andere maligne Tumore (z. B. Nierenkarzinom), nicht maligne Tumore (z. B. Uterus-Leiomyom), Arteriits ohne Bindegewebserkrankung (CTD), angeborene oder erworbene Pulmonalstenosen, Parasiten (Hydatiden-Zyste) und Fremdköperembolien.1
Epidemiologie und Risikofaktoren
Die Inzidenz der CTEPH liegt bei 2–6 Fällen pro 1 Mio. Menschen / Jahr, und die CTEPH zählt damit zu den seltenen Erkrankungen.1 Die Prävalenz beträgt bei 26–38 Fällen pro 1 Mio. Menschen, allerdings sind die Zahlen der Neuerkrankten steigend.1 Wahrscheinlich ist dies auf ein besseres Verständnis und größeres Bewusstsein für die Erkrankung zurückzuführen, insbesondere wenn Dyspnoe nach Lungenembolie und/oder weitere Risikofaktoren vorliegen.1
Patientinnen und Patienten mit einer CTEPD, bei denen eine zusätzliche PH bzw. CTEPH vermutet wird, sollten an ein PH-Expertenzentrum überwiesen werden.1 Bei einem Großteil dieser Erkrankten bestätigt sich die CTEPH-Diagnose.1
Neben pulmonalerteriellen Obstruktionen oder einer Mikrovaskulopathie sind Risikofaktoren für eine CTEPH nach einer Lungenembolie:1
Intravaskuläre Implantate (z. B. Herzschrittmacher)
Entzündliche Darmerkrankungen
Essentielle Thrombozythämie (ET)
Polycythaemia vera (PV)
Splenektomie
Antiphospholipid-Syndrom
Hochdosierte Schilddrüsenhormon-Ersatztherapie
Malignität
Klinische Charakterisierung, Schweregrad und Prognose
Bei symptomatischen Patientinnen und Patienten einer CTEPD können folgende Anzeichen auftreten:1
Durchblutungsstörungen im V/Q-Scan
Hinweise auf chronische, organisierte, fibrotische Gerinnsel
Ringförmige Stenosen
Chronische totale Okklusion nach mindestens dreimonatiger therapeutischer Antikoagulation
Die PH zeichnet sich durch Belastungsdyspnoe, Abgeschlagenheit, rasche Ermüdbarkeit und gelegentliche Synkopen aus.2
Die CTEPH gilt als eine schwerwiegende Komplikation pulmonaler Thromboembolien.2 Unbehandelt liegt die mittlere Lebenserwartung bei weniger als drei Jahren.2 Allerdings stehen mittlerweile effektive Therapieoptionen zur Verfügung.2 Auch nach erfolgreicher Therapie sind jährliche Kontrolluntersuchungen indiziert, da die PH rezidivierend sein kann.1
Den höchsten prädiktiven Wert für die Mortalität hat die Einteilung nach WHO-Funktionsklassen (WHO-FC).1
Class | Descriptiona |
|---|---|
WHO-FC I | Patients with PH but without resulting limitation of physical activity. Ordinary physical activity does not cause undue dyspnoea or fatigue, chest pain, or near syncope |
WHO-FC II | Patients with PH resulting in slight limitation of physical activity. They are comfortable at rest. Ordinary physical activity causes undue dyspnoea or fatigue, chest pain, or near syncope |
WHO-FC III | Patients with PH resulting in marked limitation of physical activity. They are comfortable at rest. Less than ordinary activity causes undue dyspnoea or fatigue, chest pain, or near syncope |
WHO-FC IV | Patients with PH with an inability to carry out any physical activity without symptoms. These patients manifest signs of right HF. Dyspnoea and/or fatigue may even be present at rest. Discomfort is increased by any physical activity |
PH, pulmonary hypertension; WHO-FC, World Health Organization functional class. | |
Tab. 1: WHO-Funktionsklasse (WHO-FC) der pulmonalen Hypertonie (PH). aFunktionelle Klassifizierung der PH, modifiziert nach der New York Heart Association (NYHA) gemäß WHO 1998. Modifiziert nach 1.
Diagnostik
Bei Verdacht auf eine CTEPH muss umgehend an ein spezialisiertes PH-Expertenzentrum für eine interdisziplinäre Betreuung überwiesen werden („Fast-Track-Referral“).1 Den diagnostischen Algorithmus beim Verdacht auf eine PH finden Sie hier.
Diagnostik
Echokardiographie: Nicht invasives Verfahren zur Diagnose der PH.1,2 Für Parameter bitte hier klicken.
Ventilations/Perfusions-Szintigraphie (V/Q-Scan) dient als Goldstandard für den Ausschluss einer CTEPH.2
Kombination aus Positronen-Emissions-Tomographie und Computertomographie (PET-CT): Zur Differenzialdiagnostik der PH-Gruppe 4.1
Rechtsherzkatheter (RHC): Goldstandard für die PH-Diagnose und Klassifizierung.1–4,6 Idealerweise findet die Durchführung bei klinisch stabilem Zustand unter optimierter Therapie der Grunderkrankung im PH-Expertenzentrum statt.1 Für Parameter bitte hier klicken.
Weitere Untersuchungen: CT-Angiographie der Pulmonalarterien (CTPA), digitale Subtraktionsangiographie (DSA)1,2
Zur Diagnosesicherung sollten CTPA, DSA und RHC in spezialisierten PH-Expertenzentren durchgeführt werden.1
Im Kontext einer akuten Lungenarterienembolie (LAE) können folgende Zeichen auf eine CTEPH hinweisen:1
Radiologische Hinweise während CTPA und/oder ein geschätzter sPAP > 60 mmHg im Echokardiogramm.
Wenn Dsypnoe oder Funktionseinschränkungen im klinischen Verlauf nach der LAE verbleiben.
Bestehende Risikofaktoren für CTEPH bei asymptomatisch Erkrankten (Risiken z. B. essentielle Thrombozythämie, Polycythaemia vera, Splenektomie, Antiphospholipid-Syndrom, Malignität, hochdosierter Schilddrüsenhormonersatz).
Die CTEPH sollte bei jedem PH-Patient und jeder PH-Patientin mit unklarer Ursache in Erwägung gezogen werden.1,2
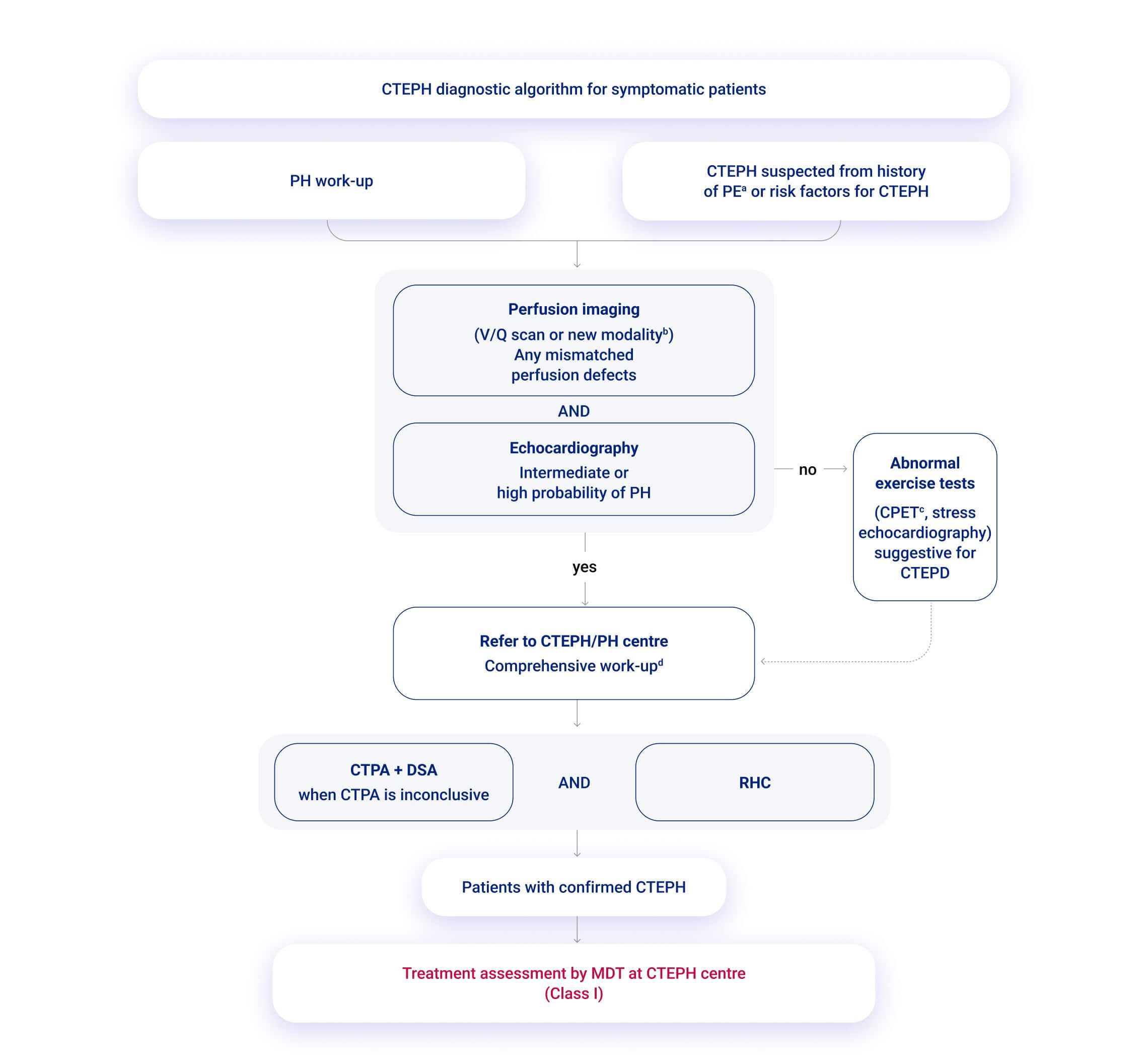
Abb. 1: Diagnostic strategy in chronic thrombo-embolic pulmonary hypertension. CPET, cardiopulmonary exercise test; CTEPD, chronic thromboembolic pulmonary disease; CTEPH, chronic thrombo-embolic pulmonary hypertension; CTPA, computed tomography pulmonary angiography; DECT, dual-energy computed tomography; DSA, digital subtraction angiography; MDT, multidisciplinary team; MRI, magnetic resonance imaging; N, no; PE, pulmonary embolism; PETCO2, end-tidal partial pressure of carbon dioxide; PH, pulmonary hypertension; ReCo, recommendation; RHC, right heart catheterization; sPAP, systolic pulmonary arterial pressure; V/Q, ventilation/perfusion; VE/VCO2, ventilatory equivalents for carbon dioxide; VO2/HR, oxygen pulse; VO2, oxygen uptake; Y, yes. aCTEPH suspected from history of PE, including elevated sPAP on echocardiography and signs suggesting CTEPH on CTPA performed at the time of the acute PE. bAlternative perfusion imaging techniques—such as iodine subtraction mapping, DECT, and MRI perfusion—are currently under evaluation. cTypical pattern, including low PETCO2, high VE/VCO2, low VO2/HR, and low peak VO2 dComprehensive work-up after 3 months of therapeutic anticoagulation or sooner in unstable or rapidly deteriorating patients. Ideally, CTPA, DSA, and RHC are performed in CTEPH centres, but they are sometimes performed in PH centres, depending on the country and organization. Modifiziert nach 1.
Weiterführende Informationen zur Diagnostik finden Sie hier und eine ausführliche Beschreibung in den aktuellen ESC/ERS-Leitlinien (2022) zur PH.1
Therapie
Der Therapiealgorithmus für die CTEPH ist multimodal, um unterschiedliche Läsionen (proximale und distale fibrotische Obstruktionen, Mikrovaskulopathie) zu erfassen.1
Die generellen Empfehlungen für eine PAH, wie etwa betreute Sportübungen, gelten auch für die CTEPH.1 Außerdem wird eine lebenslange therapeutische Antikoagulation empfohlen, obwohl bisher keine Daten aus randomisierten kontrollierten Studien bei dieser Patientengruppe vorliegen.1,2
Etwa 70 % der Patientinnen und Patienten können mit einer operativen pulmonalen Endarteriektomie (PEA, früher: Thrombendarteriektomie) geheilt werden.2 In PH-Expertenzentren liegt die perioperative Mortalität bei < 2,5 %.2
Für Betroffene einer nicht operablen CTEPH oder persistierenden PH nach einer PEA ist eine medikamentöse Therapie oder pulmonale Ballonangioplastie (BPA) möglich.1,2 Riociguat und s. c. Treprostinil sind für diese Indikation zugelassen.1,2 Weitere PH-Arzneimittel werden off-label, basierend auf unkontrollierten Studien oder eingeschränkten Zulassungen zur CTEPH-Behandlung, verwendet.1
Die BPA als interventioneller Therapieansatz ist effektiv, aber mit einer hohen Komplikationsrate verbunden.1 Daher ist die Durchführung in einem PH-Expertenzentrum unerlässlich.1
Das PH-Zentrum sollte aus einem multidisziplinären Team aus Spezialisten für PEA, BPA, PH und Thoraxradiologie bestehen.1
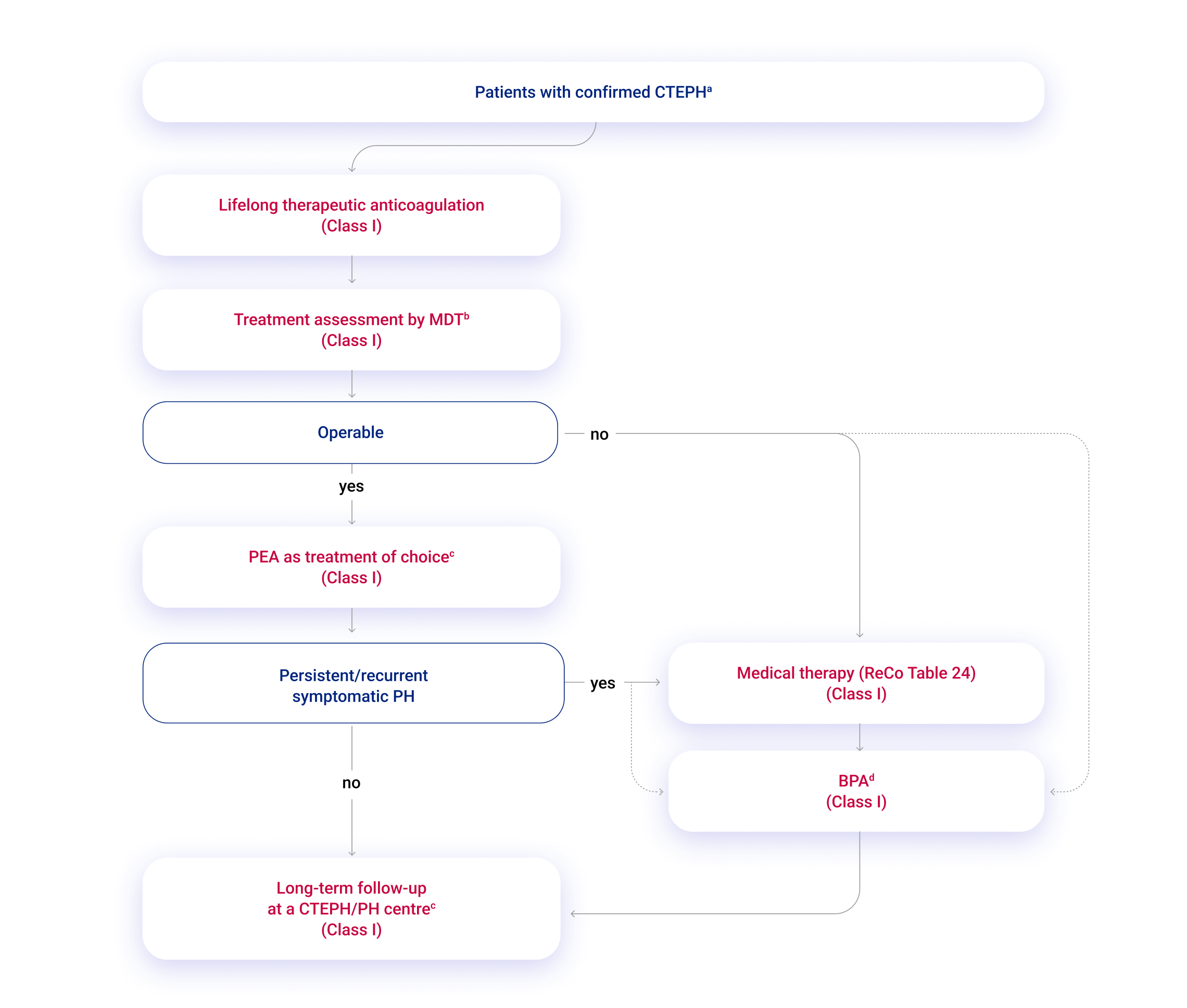
Abb. 2: Management strategy in chronic thrombo-embolic pulmonary hypertension. BPA, balloon pulmonary angioplasty; CTEPD, chronic thrombo-embolic pulmonary disease; CTEPH, chronic thrombo-embolic pulmonary hypertension; MDT, multidisciplinary team; N, no; PAH, pulmonary arterial hypertension; PEA, pulmonary endarterectomy; PH, pulmonary hypertension; PVR, pulmonary vascular resistance; ReCo, recommendation; WU, Wood units; Y, yes. aSelected symptomatic patients with CTEPD without PH can also be treated by PEA and BPA. bMDT meeting can be virtual. cTreatment assessment may differ, depending on the level of expertise in PEA and BPA. dFor inoperable patients with PVR .4 WU, medical therapy should be considered prior to BPA; there are limited data on BPA as first-line therapy. Modifiziert nach 1.
Eine ausführliche Beschreibung der therapeutischen Strategie ist in den aktuellen ESC/ERS-Leitlinien (2022) zur PH zu finden.1
Verdacht auf PH?
Bei Verdacht auf PH infolge pulmonalarterieller Obstruktionen kontaktieren Sie hier unsere PH-Experten, um sich auszutauschen oder ein PH-Expertenzentrum in der Nähe.

CTEPD: Chronisch thromboembolische Lungenerkrankung (Überbegriff)
CTEPH: Chronisch thromboembolische pulmonale Hypertonie
CTPA: CT-Angiographie der Pulmonalarterien
DSA: Digitale Subtraktionsangiographie
LAE: Akute Lungenarterienembolie
mPAP: Mittlerer Pulmonalarteriendruck
PAH: Pulmonale arterielle Hypertonie
PAWP: Pulmonalarterienverschlussdruck
PEA: Pulmonale Endarteriektomie
PET-CT: Positronen-Emissions-Tomographie und Computertomographie
PH: Pulmonale Hypertonie
PVR: Pulmonalvaskulärer Widerstand
RHC: Rechtsherzkatheteruntersuchung
s. c.: Subkutan
sPAP: Systolischer pulmonalarterieller Druck
V/Q-Scan: Ventilations/Perfusions-Szintigraphie
WHO: World Health Organization
1. Humbert M et al. Eur Heart J 2022; 43(38): 3818–3731.
2. Olsson KM et al. Dtsch Arztebl Int 2014; 111: 856–862.